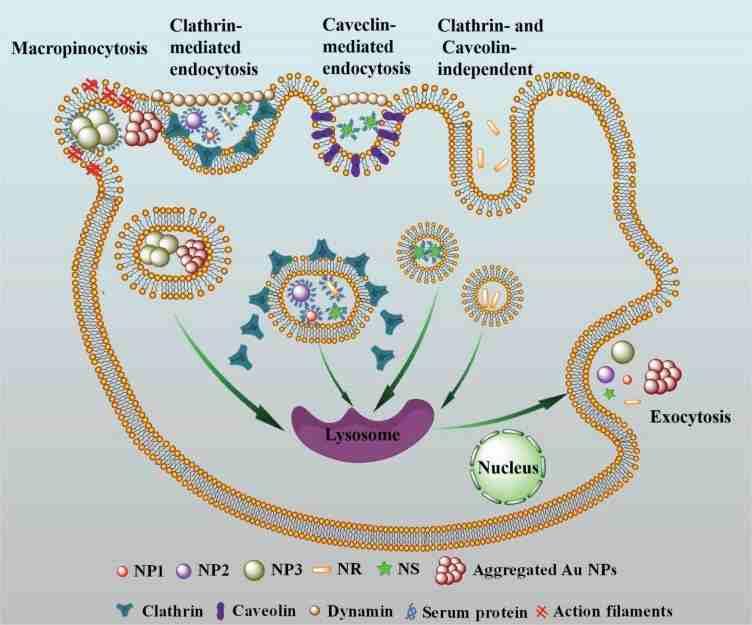
金纳米颗粒的大小、形状和蛋白电晕在细胞摄取和去除机制中起关键作用。15 nm纳米颗粒(NP1)、45 nm纳米颗粒(NP2)和杆状纳米颗粒(NR)通过受体介导的内吞(RME)途径进入细胞。星形纳米颗粒(NS)不仅通过网格蛋白介导,也通过小腔蛋白介导的内吞途径。而80 nm的纳米颗粒(NP3)由于体积较大,主要通过大胞饮途径进入细胞。此外,蛋白质电晕的存在可以改变Au NPs的吸收机制。在非胎牛血清包被条件下,NP1、NP2和NS的内吞途径从RME途径改变为大胞饮途径,NR从RME途径改变为clathrin和caveolin非依赖性途径。包覆和非包覆的五种Au NPs都通过溶酶体胞外分泌途径释放出来。蛋白冠的大小、形状和蛋白冠对胞吐率和胞吐量均有影响,但不改变胞吐机制。系统研究不同大小、不同形状金纳米粒子的胞吞和胞吐作用机制,有助于金纳米粒子的毒理学评价和纳米药物应用。
我们研究了五种Au NPs的吸收、去除和机理。我们证明了大小、形状和蛋白冠在Au NPs的细胞摄取和去除机制中起关键作用。这些NPs的吸收机制是不同的。NP1、NP2、NR的摄取是网格蛋白受体介导的内吞途径。NS不仅是网格蛋白介导的胞吞途径,也是小穴蛋白介导的胞吞途径。NP3主要通过大胞饮作用,因其体积较大而诱导聚集。蛋白冠降低了NPs的聚集,从而导致细胞摄取量的减少。我们还发现,蛋白冠影响内吞机制。非fbs包被的NP1、NP2和NS的胞吞途径由RME途径向大胞吞途径转变。大小、形状和蛋白质冠对胞吐机制没有影响。五种Au NPs通过溶酶体胞吐途径释放。胞吐率和胞吐量是大小相关的。较小的NPs似乎以较快的速率外逸。本研究有助于理解金NPs的胞吞和胞吐机制,为金NPs在生物医学领域的应用提供指导。
https://onlinelibrary.wiley.com/doi/full/10.1002/smll.201801451